細胞の透過処理と固定
(Permeabilization and fixation)
[English version]
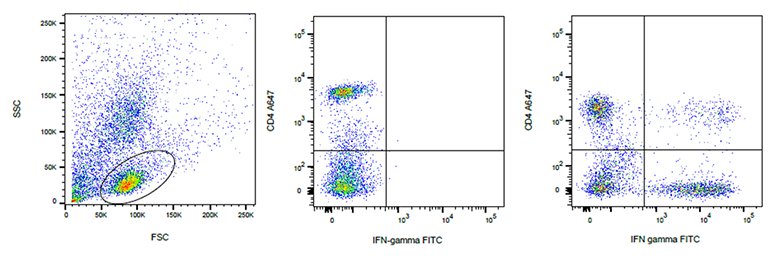
標識抗体のような大きな分子は細胞膜を通過して、細胞内部に入ることができないため、サイトカインなどの細胞内抗原には固定化・透過処理が必要になります。細胞内抗原の染色にはまず、細胞を懸濁液中で固定し、次に抗体を添加する前に透過処理を行う必要があります。 固定液の選択は重要なステップです。 ホルムアルデヒドやグルタルアルデヒドはリジン残基間を結合することで、タンパク質を架橋します。ただし、グルタルアルデヒドは自家蛍光を増加させます。 サンプルによりますが、通常PBS中に0.5~4%の濃度で使用されます。 長期間サンプルを保管する場合は1-2時間後には固定液から細胞を取り出す必要があります。
ホルムアルデヒド固定処理ではサンプルの透過性は上がらないため、透過処理を別に行う必要があります。 透過処理により、標識抗体などのプローブは、細胞の形態学的な特性を損なわずに細胞内構造にアクセスすることが可能になります。 Tritonやジギトニン、サポニンは、細胞膜を破壊することによって作用する透過化試薬です。透過処理の度合いは重要で、例えば、細胞質と核内のように抗原の局在性によって異なるレベルの透過処理が必要ですし、また、結合しなかった抗体が細胞から十分に洗い流される必要があります。Leucoperm™(図28)のように、固定化と透過化の両方を行うための試薬も市販されています。
固定剤としてのアルコール(Alcohols as Fixatives)
アルコールもまた固定剤としても使用されます。通常、冷70%溶液で用いて、タンパク質を変性させることによって固定します。 利点としては、細胞膜も透過性になり、4℃や-20℃での長期保存に適していることです。 しかしながら、アルコール固定による変性プロセスによって、抗原のエピトープがマスクされることがあるので、実験条件の最適化が必要なことがあります。DNA解析では、アルコールは最も一般的に使用される固定剤です。
- Flow Cytometry - Basics Guide
- 第5章 - 実験の最適化
- サンプル調製(Sample preparation)
- 自家蛍光(Autofluorescence )
- 死細胞除去(Live/dead exclusion )
- ダブレット除去(Doublet discrimination)
- データ収集(Cell collection)
- 細胞の透過処理と固定(Permeabilization and fixation)