プロテインA担体の代わりに陽イオン交換担体で抗体の精製を
このコーナーでは、定期的にバイオ・ラッドの新製品や技術情報のトピックをご紹介します。
抗体精製の一般的な方法は、初めにプロテインAまたはGによりアフィニティ精製を行います。さらに純度を上げる場合は、イオン交換やCHT(セラミックハイドロキシアパタイト)などを組み合わせて2-3ステップかけることもあります。プロテインA/Gでの精製は酸性条件下での溶出を行うため、溶出中に抗体の凝集や変性など、抗体の活性に悪い影響を及ぼしてしまう恐れがあります。
今回、陽イオン交換担体のNuvia Sを用いることで、pHが4.5-5のマイルドな条件下でのモノクローナル抗体の精製を可能にすることを示しました。
下図のAは、CHO細胞培養からのモノクローナル抗体をNuvia Sで精製したときのクロマトグラムです。2段階のステップワイズ溶出で、2ステップ目で抗体を溶出しています。
図Aのフラクションのうち、バッファーBで洗浄したフラクション番号2-9をSDS-PAGEとMALDI-TOF MSで確認の結果、脱落した抗体のL鎖の分解物が回収されていることが分かり、バッファーCで溶出して回収したフラクション番号11-15には分解していない抗体が回収されていることがわかりました(図B)。
また、SEC-HPLCでの分析の結果でもフラクション番号11-15には分解または凝集した抗体が含まれていないことが確認されました(図C)。
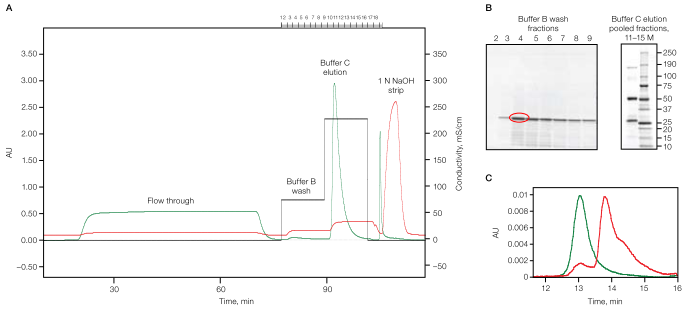
|
| A: CHO細胞培養からのモノクローナル抗体をNuvia Sで精製したときのクロマトグラム B: フラクション2-9(左図)および11-15(右図)の電気泳動像 (フラクション4(赤丸)はMALDI-TOF Massで確認) C: SEC-HPLCでの確認(Red: フラクション2-9、Green: フラクション11-15) |
一般的にプロテインA担体の抗体吸着量は20-40mg/mlですが、Nuvia Sの抗体吸着量は100mg/ml以上です。プロテインA担体に比べてコスト削減が期待できますので、プロセスレベルへの展開にも期待できます。
- Nuvia Sを使用した抗体精製の技術資料(Bulletin 5984): Nuvia S Media: A High-Capacity Cation Exchanger for Process Purification of Monoclonal Antibodies
- Nuvia Sについての製品紹介(Bulletin 5987): Nuvia S Cation Exchange Media Product Information Sheet
- Nuvia Qについての製品紹介(Bulletin 6129): Nuvia™ Q Anion Exchange Resin Product Information Sheet, Ver B
- 安定性が増した第2世代CHTハイドロキシアパタイト登場 MPCセラミックハイドロキシフルオロアパタイト
- 医薬品・食品・バイオ燃料の研究に活用されている低分子化合物の分析用HPLCカラム
- タグタンパク質や抗体を高純度に精製するためのワークフロー
- 困ってからじゃ遅い!初めにCHTセラミックハイドロキシアパタイトを選択してみては?
- 高流速、高分離能、高再現性のサイズ排除(ゲルろ過)カラム-ENrich SECカラム
- ミックスモードクロマトグラフィーなら、Nuvia cPrimeでしょう!!
- アフィニティタグのないリコンビナントタンパク質を全自動で精製!
- ワンステップでタンパク質精製とOn-column Refoldingを
- 待ちきれないタンパク質の精製~確認をもっと早く!
~リコンビナントタンパク質精製の高速ワークフロー~