Peptide Ligand Library と In-Gel IEF の応用による網羅的なショットガンプロテオミクス
このコーナーでは、定期的にバイオ・ラッドの新製品や技術情報のトピックをご紹介します。
ProteoMinerは、コンビナトリアルペプチドのリガンドライブラリーが結合したビーズを用いることにより、生体サンプル中のタンパク質含有量の違い(ダイナミックレンジ)を圧縮することができるサンプル処理ツールです。その一方で、タンパク質を網羅的にLC-MSで同定するショットガンアプローチにおいて、等電点電気泳動(IEF)による前分画が有効であることが示されています(Bulletin 6140)。
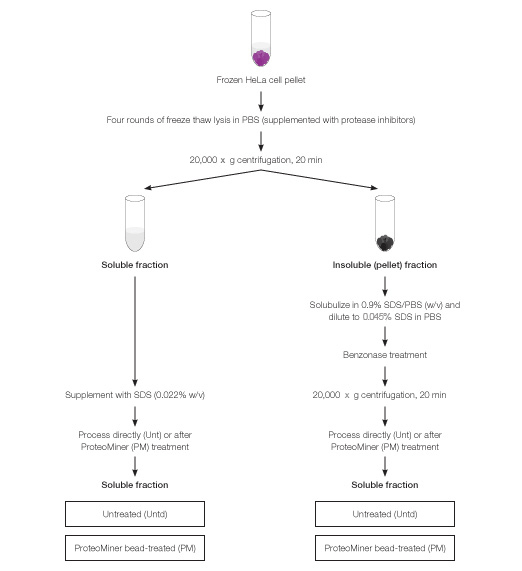
今回ご紹介します資料では、この両者の技術を組み合わせた以下のようなプロトコールよって、HeLa細胞のライセートから網羅的にタンパク質を同定することを試みています。
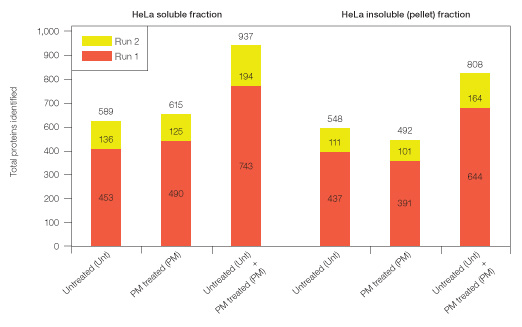
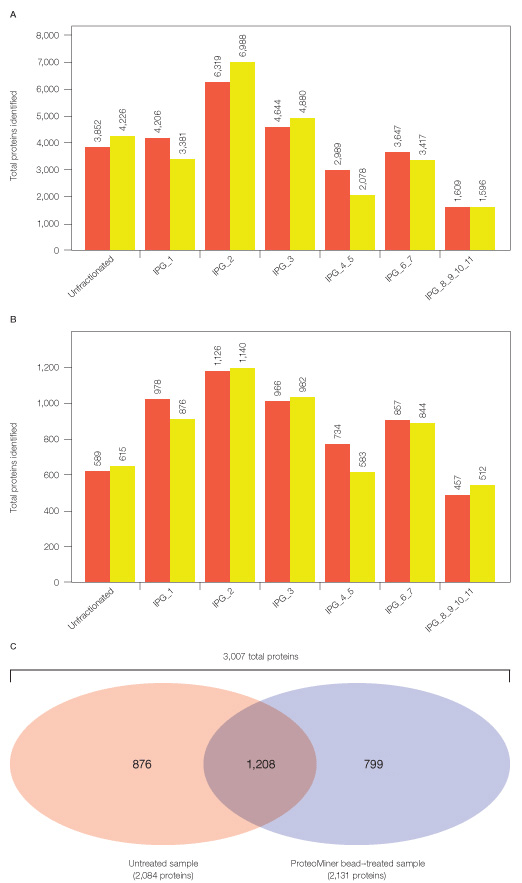
まず、ProteoMiner未処理のHeLa可溶性ライセートをトリプシン消化して直接LC-MS/MSで分析したところ、タンパク質同定数は589個だったのに対し、ProteoMiner処理したライセートで固有に同定されたタンパク質を加算すると937個と約1.6倍に増加しました。さらに、ProteoMiner処理ならびに未処理のペプチドをそれぞれIn-Gel IEFで前分画してLC-MS/MSで分析すると、同定タンパク質の総数は3,007個にもなることが示されました。
このように発現量の少ないタンパク質を検出するためのサンプル処理方法として、ProteoMinerによるダイナミックレンジの圧縮と、In-Gel IEFによるペプチド分画を組み合わせることは非常に有効な手段であることが分かりました。さらに、ProteoMiner処理ならびに未処理のサンプルを両方組み合わせて分析することによって、検出ペプチドの網羅性の向上にもつながります。
電気泳動サンプル調製
等電点電気泳動関連
- 等電点電気泳動のショットガンアプローチへの応用
- 困ったときは 2D ドクターに相談してみよう!
- もっと気軽に二次元電気泳動条件の最適化を!
- 1ステップ蛍光染色!~二次元電気泳動から質量分析へのワークフロー~
ウェスタンブロッティング関連(転写・検出)
- 様々な用途に使用できるStain-Freeのテクノロジー ~ウェスタンブロッティングにおける総タンパク質補正~
- ChemiDoc Touch を使用したお客様からの喜びの声
- ウェスタンのバンドは濃すぎず、ほどほどに!
- こんなに変わるの? 蛍光ウェスタンの実験プロトコル最適化のポイント
- その化学発光、本当に正しく定量できていますか?
- より安全なバイオ医薬品開発のための2-Dウェスタンワークフロー
- 2Dだけじゃない!Western Blotのトラブルも診断してくれるBio-Radのドクターシリーズ
- これから蛍光ウエスタンを始める方のために
- 失敗の少ないウェスタン、定量性あるウェスタンのために必要なソリューションとは? ~Stain-Freeウェスタンブロッティング
- 200kDaの高分子タンパク質でも、10分間で高効率な転写!
- ブロッティングの検出は化学発光からマルチ蛍光検出へシフト中
- ケミルミで検出したバンドの分子量計算にお困りではないですか?
~プレシジョンPlus WesternCスタンダードなら可視検出にもケミルミ検出にも対応~ - X線フィルムと化学発光撮影装置、どちらが便利?