死細胞除去
(Live/dead exclusion)
[English version]
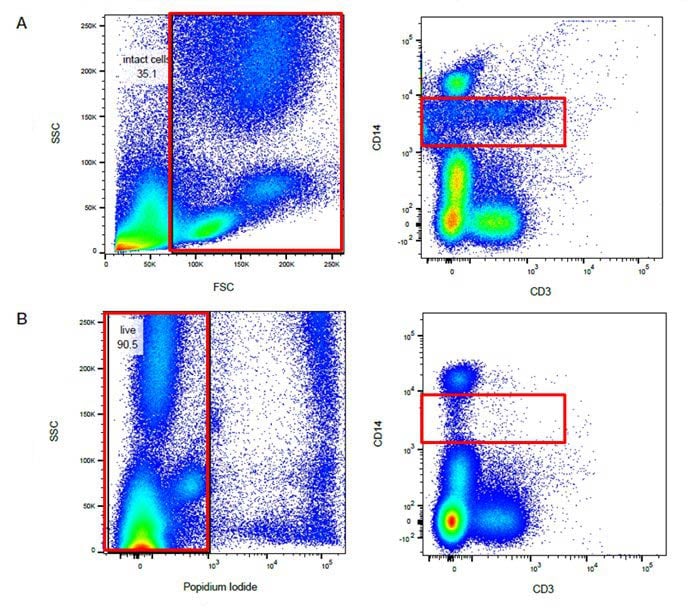
サンプル中の死細胞の存在は染色性に大きく影響し、さらにはデータの品質にも影響します。 これは、死細胞がより強い自家蛍光を発し、非特異的な抗体結合も多いため、偽陽性(False Positive)の原因となり、ダイナミックレンジ(Dynamic Range)を減少させるためです。 そのため、弱陽性のサンプルや存在比率の少ない集団の同定を困難にします。 前方散乱光(FSC)と側方散乱光(SSC)に基づいたゲートを使用することで、細胞片(debris)や死細胞を取り除くこともできますが、すべてを除去はできません。 このため、死細胞と生細胞を区別するための色素が開発されています。
核酸結合色素(Nucleic Acid Binding Dyes)
生存率試薬のグループの一つは、核酸結合色素です。 このグループには488nmおよび561nmレーザーの両方によって励起可能なropidium Iodide(PI)および7-AADが含まれます。 それらは二本鎖核酸に結合すると蛍光を発します。 これらの色素は膜透過性ではないため、生細胞では排除されます。 抗体での染色後、サンプルに直接添加し、簡単にインキュベートすることで細胞に取り込まれます。 次いで、染色されていない集団(生細胞)をゲーティングすることで、死んだ細胞は解析対象から除去されます。 この方法は、生きた細胞の細胞膜が色素を通さないことによるため、固定処理をしたサンプルには使えません。
タンパク質結合色素(Protein Binding Dyes)
サンプルから死細胞を区別するために利用可能な生存性色素(Viability Dye)の2つめのグループは、DNA結合色素ではなくタンパク質に共有結合する色素です。 これらの色素は、生細胞と死細胞の両方に結合します(図25)。 しかし、死細胞や死にかけている細胞は細胞膜が傷ついているため、色素が細胞内に浸透してより多くの量のタンパク質と結合するため、より高い蛍光を発します。 DNA結合色素と同様に、染色されていない集団(生細胞)をゲーティングすることによって、死細胞を除去することができます。
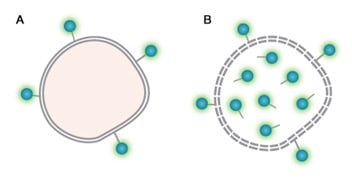
これらの色素の利点は、色素がタンパク質に共有結合するため、生細胞と死細胞との間の分解能を低下させることなく染色後の細胞の固定や洗浄を行うことができることです(細胞を固定処理しないで使用することもできます。)。 さらに、DNA結合色素よりも幅広い励起および蛍光スペクトルの製品を選択できるため、マルチカラーフローサイトメトリーパネルへ組込み易いことも挙げられます。
- Flow Cytometry - Basics Guide
- 第5章 - 実験の最適化
- サンプル調製(Sample preparation)
- 自家蛍光(Autofluorescence )
- 死細胞除去(Live/dead exclusion )
- ダブレット除去(Doublet discrimination)
- データ収集(Cell collection)
- 細胞の透過処理と固定(Permeabilization and fixation)