アイソタイプコントロール
(Isotype controls)
[English version]
フローサイトメトリーにおいて、アイソタイプコントロールを使用するかどうかは、論争の的であり、研究者を二分しています(Herzenberg Lら、Maecker HTおよびTrotter J)。 アイソタイプコントロールを使用しないこともできますが、使用する場合には、適切に使用するための、そして他のコントロールと一緒に使用するためのいくつかの簡単なルールがあります。
アイソタイプコントロールとは何か?(What are Isotype Controls?)
フローサイトメトリーでは、存在比率の少ない細胞集団や発現レベルの低い細胞を検出する場合、あるいはマルチカラーパネルを構築する場合に、染色のバックグラウンドレベルが特に問題となります。 アイソタイプコントロールは、解析対象の細胞またはサンプルには存在しない抗原に対して産生された抗体です。観察された染色がアーティファクトではなく目的抗原への特異的な結合によるものであることを確認にすることが目的です。 陽性と陰性細胞を区別するためや、ゲートを決定するために使用すべきではなく、また、細胞内の染色には適していません。
アイソタイプコントロールは:
- 単球、マクロファージ、樹状細胞およびB細胞の表面上に見出されるFc受容体に対する抗体の非特異的結合量の評価に用いられます。
- 観察された染色がアーティファクトではなく特異的結合によるものであることの確認に用いられます。
- 抗体または蛍光色素の細胞成分への他の非特異的結合を明らかにします(例えば、RPEおよびFITC、Takizawaら、1993、Hulspasら、2009)。
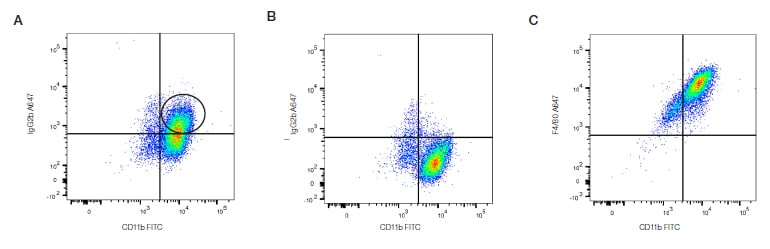
最も適切なアイソタイプコントロールは以下を一致させます。
- 免疫生物種
- Igサブクラス
- 一次抗体の蛍光色素
もしFITCに結合したマウスIgG1モノクローナル抗体を使用する場合には、FITCに結合したマウスIgG1アイソタイプコントロールを選択する必要があります。
抗体への蛍光色素の結合比(F/P Ratio*と呼ばれます)は試薬メーカーによって異なることがあるので、目的の抗体と同じメーカーからアイソタイプを購入することが推奨されます。 可能であれば、一次抗体と同じ濃度で使用してください。
(*)F/P比:Calculated dye: protein molar ratios:溶液中の抗体に結合した色素分子の平均数の比率
4つの簡単なステップで抗体のFP比を計算する方法(How to Calculate the FP ratio of Your Antibodies in Four Easy Steps)
F/P Ratio (蛍光色素:タンパク質比)を決定するには、分光光度計で既知の波長での吸光度に基づいて蛍光色素とタンパク質の両方のモル濃度を計算し、比率としてこれを示します。 この比率は、溶液中の抗体に結合した色素分子の平均個数を示します。
1. 過剰な蛍光色素の除去
過剰な蛍光色素は、吸光度測定を妨げます。
2. タンパク質の濃度の決定
A280 nmでのタンパク質の吸光度を測定します。この値をタンパク質のモル吸光係数で割ります。(例えば、マウスIgGは、203,000M-1 cm-1のモル吸光係数を有する)。
3. 蛍光色素濃度の決定
最大励起波長(例えばFITCでは495nm波長)で蛍光色素の吸光度を測定します。この値を色素分子のモル吸光係数で割る。 (例えばFITCは75,000M -1 cm-1の吸光係数を有する)。
4. F/P比の決定
ステップ2で決定した蛍光色素濃度をステップ3で決定したタンパク質濃度で割ってF/P比を計算します。
アイソタイプコントロールは細胞表面染色の際の使用に適していますが、細胞内染色の場合には注意が必要です。細胞内分子を染色する場合、抗体だけでなく蛍光色素も細胞内成分に非特異的に結合することがあり、そのため蛍光色素の選択に注意する必要があります。また、細胞表面染色の際とは異なるコントロールが必要になる場合もあります。アイソタイプコントロールを使用して、コンペンセーションレベルまたは負の母集団を決定することはできません。
非特異的な抗体結合は次のようにして減らすことが可能です。
- Fcレセプターをブロックする
- バッファーにBSAなどのタンパク質を加える
- 抗体価を測定しておく(Antibody titration)
- Live/deadマーカーを使って死んだ細胞を除外(ゲートアウト)する
アイソクロニックコントロール(Isoclonic Controls)
アイソタイプコントロールの代替法の一つは、アイソクロニックコントロールです。 これは過剰量の同一の非標識抗体で染色した細胞です。 非標識抗体はすべての結合部位を占め、標識抗体が特異的に結合するのを妨げます。 従って、アイソクロニックコントロールの存在下で検出される任意のシグナルは、非特異的結合に由来します。
- Flow Cytometry - Basics Guide
- 第4章 - フローサイトメトリーのコントロール
- 無染色コントロール(Unstained controls)
- アイソタイプコントロール(Isotype controls )
- 単一染色とコンペンセーションコントロール(Single staining and compensation controls)
- Fcブロッキングコントロール(Fc blocking controls )
- FMO(Fluorescence minus one)コントロール (Fluorescence minus one controls )
- 細胞内染色コントロール(Intracellular staining controls )
- バイオロジカルコントロール(Biological controls)